
Ernest Rutherford
(30 de agosto de 1871, Brightwater, Nueva Zelanda – 19 de octubre de 1937, Cambridge, Reino Unido)

Por Emperatriz Guerrero
Asociación Larense de Astronomía, ALDA
Ernest Rutherford, también conocido como Lord Rutherford, fue un físico neozelandés reconocido por su modelo del átomo de 1911, gracias al cual se comprobó la existencia del núcleo atómico y sus características.
Nacido cerca de la localidad de Brightwater, en plena zona rural de Nelson, en la Isla Sur de Nueva Zelanda, fue el cuarto de los doce hijos de James Rutherford, un carretero escocés y su esposa Martha Thompson, una refugiada de las Guerras de Taranaki de la Isla Norte.
Su temprana infancia transcurrió en una granja en Fox Hill, donde su madre trabajaba como maestra. El vivir en un ambiente rural, despertó desde muy temprano en el joven Ernest la curiosidad por los fenómenos de la naturaleza. Sus padres y maestros fueron influencias decisivas en su vida. Ingresado en la escuela de Fox Hill, el director H. Ladley observó el interés del niño en las matemáticas, de modo que le dio un libro de ciencias, el cual catalizó su atención al punto que muy pronto desarmaba y armaba relojes, cámaras y otros aparatos, que utilizaba en el trabajo de la granja.
A los 11 años, la familia se trasladó a Havelock porque los ingresos de la granja no bastaban para los catorce miembros, donde su padre y tío instalaron un molino de lino, que era para entonces una actividad muy lucrativa. Aunque el molino, a orillas del río Ruapaka, estaba cerca de Havelock, el padre de Ernest sólo regresaba los fines de semana.
En este tiempo, Ernest asistió a la escuela de Havelock, donde el director Jacob Reynolds resultó influencia decisiva en su orientación hacia las matemáticas, y a quien le escribió en reconocimiento, tras ganar el Premio Nobel de Química en 1908.
La estancia en Havelock si bien trajo mejoras económicas a la familia, trajo también la muerte de tres de los hermanos de Ernest. Percy, de un año, murió de tosferina, y Charles y Herbert, de 10 y 12 años respectivamente, fallecieron tres años después, ahogados en un viaje de pesca con unos amigos. Ernest debía acompañarlos, pero lo enviaron al molino. Sin embargo, fue el encargado de dar la terrible noticia a su madre, a quien halló tocando el piano. Desde ese día, Martha Rutherford no volvió a tocarlo y decidió que Ernest y su hermano Jim tomaran clases de natación.
El impacto de este accidente afectó a Ernest en su intento de obtener la beca Marlborough para el Nelson College, consiguiéndolo en su segundo intento, con 580 puntos sobre 600. De 1887 a 1889, fue el mejor en las distintas asignaturas, obteniendo elogiosos comentarios del director. Además de destacarse en los estudios, también lo hizo en el rugby.
Posteriormente, en 1890, ganó la beca para el Canterbury College de Chirstchurch, uno de los cuatro campus de la Universidad de Nueva Zelanda, donde obtuvo su licenciatura en Bachelor of Arts en 1892 y al año siguiente se tituló Master of Arts con honores de primera clase en Ciencias Físicas, Matemáticas y Física Matemática. Un año más tarde, en 1894, obtuvo el título de Bachelor of Science gracias a una serie de investigaciones independientes.
Una de estas, basada en los trabajos de Heinrich Hertz sobre radiaciones electromagnéticas, hoy conocidas como ondas de radio, lo llevaron a medir su efecto en agujas magnetizadas, inventando así el primer detector sensible a las ondas de radio, siendo parte de los inicios de la telegrafía inalámbrica. Fue este trabajo el que le valió una beca de investigación en la Universidad de Cambridge, Inglaterra, en el Laboratorio Cavendish, comenzando a trabajar en 1895 junto a Joseph John Thomson, experto en radiación electromagnética.
Su colaboración con Thomson en el estudio de la modificación de la conductividad de los gases por los rayos X, llevó a este científico a descubrir e identificar en 1897 la primera partícula subatómica: el electrón. A partir de este descubrimiento, Thomson postuló en 1904 un modelo atómico en el cual los electrones se encontraban en movimiento, dispersos a intervalos angulares regulares dentro de una matriz esférica de carga positiva que representaba todo el volumen del átomo, siendo llamado “modelo del pudín de pasas”.
Recomendado por Thomson, Rutherford fue nombrado en 1898 Profesor de Física en la Universidad McGill de Montreal, Canadá, donde tuvo su propio laboratorio de investigación, dedicándose a partir de 1899 a estudiar el poder de penetración de la radiación del uranio. Para ello cubría sus muestras con hojas metálicas de distintos espesores. Encontró que la radiación disminuía rápidamente al aumentar el espesor de las hojas, pero que al llegar a cierto espesor comenzaba a disminuir lentamente, deduciendo que debían existir dos tipos de radiación diferente. Denominó radiación alfa a la menos penetrante y radiación beta a la más penetrante.
En 1900, mientras estudiaba el torio con el mismo equipo del uranio, notó que los movimientos de aire perturbaban los experimentos, descubriendo que este elemento emitía emanaciones radiactivas que permanecían activas unos 10 minutos, y que su radiactividad decrecía exponencialmente, hallando así el período de los elementos radiactivos. En 1902, con ayuda del químico Frederick Soddy, comenzó a probar la teoría de la desintegración del átomo como explicación del fenómeno de radiactividad. Descubrió así que los átomos no eran indestructibles y que efectivamente su desintegración espontánea generaba la radiactividad. Al desaparecer los elementos radiactivos, se generaban nuevos elementos químicos con características distintas a los originales. Este descubrimiento originó una revolución en el mundo de la Química y la forma de concebir la materia.
Calculó también que la energía térmica producida por la desintegración nuclear, era de 20.000 a 100.000 veces superior a la de una reacción química, y que tal resultado podía explicar la energía producida por el Sol y la conservación del calor del núcleo de la Tierra.
Sus investigaciones fueron reconocidas en 1903 por la Royal Society, y en 1904 le otorgó la Medalla Rumford. Ese mismo año publicó sus resultados en su libro Radiactividad.
En 1907, acuñó el término “período de vida media” para referirse al tiempo que tardaría un átomo radiactivo en perder la mitad de su valor radiactivo original. Ese mismo año retornó a Inglaterra para ocupar la cátedra de Física de la Universidad de Manchester. Estando ahí, y junto a Hans Geiger, construyeron un contador de partículas alfa, el futuro contador Geiger. Con este dispositivo les fue posible estimar el número de Avogadro averiguando el período de desintegración del radio al medir el número de desintegraciones por unidad de tiempo, y deduciendo el número de átomos de radio de la muestra.
En 1908, junto a Thomas Royds, uno de sus estudiantes, demuestra que una vez liberadas de su carga, las partículas alfa son núcleos de helio.
Ernest Rutherford fue galardonado con el Premio Nobel de Química en 1908 "…por sus investigaciones sobre la desintegración de los elementos y la química de las sustancias radiactivas", convirtiéndose así en el primer nativo de Oceanía en recibirlo.
En 1909, estando en la Universidad de Manchester y trabajando junto con Hans Geiger y Esnerst Marsden, llevó a cabo el experimento de la lámina de oro. En este experimento se bombardeó con partículas alfa una lámina de oro de 100 nm de espesor. Las partículas alfa son de carga positiva, de modo que si el modelo atómico de Thomson era correcto, los rayos atravesarían la lámina de oro prácticamente sin desviarse, dado que no existiría ningún obstáculo mayor a un electrón y la carga positiva estaría dispersa. Para registrar los impactos de las partículas alfa, se colocó alrededor de la lámina de oro una pantalla fluorescente de sulfuro de zinc, que brillaba cada vez que era impactada por una partícula.
Sin embargo, se registraron partículas reflejadas por la lámina de oro. De las partículas que atravesaron la lámina, algunas incidieron prácticamente sin desviarse de la dirección de emisión de las partículas, pero otras resultaron desviadas en su trayectoria. El resultado fue tan sorprendente que en su discusión expresó:
“Fue el evento más increíble que me ha pasado en mi vida. Fue casi tan increíble como si dispararas un proyectil de 15 pulgadas a un trozo de papel de seda y volviera y te golpeara.” (Andrade, E. (1964) Rutherford and the nature of the atom).
Estos resultados llevaron a Rutherford a concluir que en el átomo debía existir un centro de fuerte carga positiva que desviaba a las partículas alfa cuando chocaban contra él. Tomando en cuenta las partículas reflejadas y desviadas con las que no lo eran, pudo determinar el tamaño del núcleo del átomo de oro y establecer que la mayor parte del átomo, considerado los electrones, es espacio vacío.
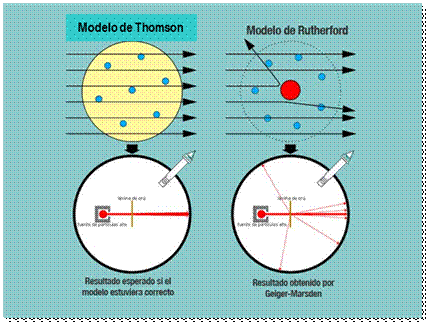
Experimento de la lámina de oro. Resultados esperado y obtenido
Esto fue crucial para la formulación en 1911 del modelo atómico de Rutherford, en el cual se proponía un núcleo central cargado positivamente que abarcaba casi toda la masa del átomo, rodeado por electrones de carga negativa y escasa masa. Este modelo fue fundamental para el desarrollo de la física atómica y la física nuclear y de partículas. Más tarde, sería perfeccionado por su discípulo Niels Bohr, con quien Rutherford mantuvo una estrecha amistad.
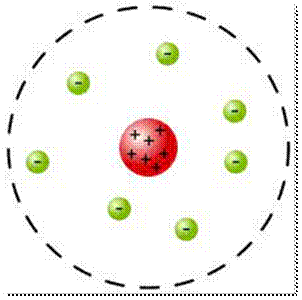
Modelo atómico de Rutherford
El modelo de Rutherford rescataba los postulados del modelo de atómico de Hantarō Nagaoka propuesto en 1904, donde por primera vez se propuso la existencia de un núcleo atómico muy masivo, con los electrones orbitando en un anillo, distribuidos en intervalos angulares regulares y girando a igual velocidad. Dada la similitud de este modelo con Saturno, se llamó a éste modelo saturniano. Sin embargo, Rutherford sostenía un núcleo más pequeño, y descartaba los electrones formando un anillo único con carga eléctrica, porque habría sido inestable a las oscilaciones en una dirección ortogonal a su plano de rotación.
En un principio Rutherford no señaló el posible movimiento de los electrones, porque sabía que su revolución alrededor del núcleo central provocaría la emisión de ondas electromagnéticas que llevarían a su colapso. Sin embargo, considerando al átomo como un sistema dinámico, empezó a representarlo con los electrones girando alrededor del núcleo central en órbitas concéntricas, tal como los planetas del Sistema Solar. Para lograr el equilibrio, supuso que en cada órbita la velocidad del electrón debía ser tal que neutralizara la atracción eléctrica del núcleo. Debido a esto, su modelo se conoce como modelo planetario.
Rutherford no especificó cuáles debían ser las distancias de los electrones al núcleo, ni sus velocidades. Esto sólo fue una asunción para explicar la estabilidad del átomo según su modelo. Esta idea sería retomada más tarde por Niels Böhr para intentar explicar las líneas espectrales de los elementos y la discontinuidad del espectro atómico, aspectos que tampoco explicaba el modelo de Rutherford, para finalmente derivar su propio modelo.
Ese año de 1911, asistió a la Primera Conferencia Solvay, donde participó junto a toda una pléyade de físicos y químicos de la época.

Primera Conferencia Solvay (Bruselas, 1911).
Rutherford es el cuarto por la derecha en la fila posterior, detrás de
Marie Curie y Henri Poincaré
Cuando estalla la Primera Guerra Mundial en 1914, Rutherford trabajó en la detección acústica de submarinos.
En 1919, tras el conflicto bélico, detectó por primera vez el proceso de transmutación, bombardeando átomos de nitrógeno con partículas alfa, que son núcleos de helio, y observando que el gas alrededor contiene una concentración mayor de oxígeno al final del experimento, lo que lo lleva a deducir que el nitrógeno ha absorbido las partículas alfa que golpearon su núcleo, adquiriendo un protón y convirtiéndose en oxígeno. Por esto, muchos consideran a Rutherford el primer alquimista exitoso de la historia.
Ese mismo año de 1919 sucede a Thomson en el laboratorio de Cavendish, llegando a ser el director y permaneciendo hasta 1937. Esta fue una época dorada para Rutherford y para su institución. James Chadwick, Niels Böhr, Robert Oppenheimer, John Crockfort, Ernest Walton y Patrick Blackett, entre otros destacados físicos, estudiaron en el laboratorio en ese momento, y realizaron valiosos descubrimientos bajo la tutela de Rutherford.
En 1937, ingresó en un hospital para una cirugía de emergencia por una hernia de larga data que se había estrangulado. Aunque el procedimiento fue exitoso, su estado de salud se agravó repentinamente, falleciendo cuatro días después, el 19 de octubre, a los 66 años.
El cuerpo de Ernest Rutherford descansa en la abadía de Westminster, junto a Isaac Newton y William Thomson, más conocido como Lord Kelvin.
Rutherford había conocido en su estancia en el Canterbury College de Christchurch, a Mary Georgina Newton, hija de su casera, con quien se comprometió antes de dejar Nueva Zelanda. Su puesto en la Universidad de Montreal le permitió la holgura económica suficiente para casarse con ella en Christchurch en 1900. De su unión nació una única hija, Eileen Mary, en 1901. Eileen se casaría con el físico y astrónomo británico Sir Ralph Howard Fowler. Lamentablemente, en 1931 murió a los nueve días de dar a luz a su cuarto hijo, situación que dejó profundamente conmocionado a Rutherford.
Durante su vida, Rutherford recibió numerosos reconocimientos. Además del Premio Nobel, fue miembro de la Royal Society de Londres, llegando a presidirla de 1925 a 1930. Le fueron concedidos los títulos de Sir en 1914 y de Barón Rutherford de Nelson en 1931.
El cráter lunar Rutherford, el cráter marciano Rutherford y el asteroide (1249) Rutherford honran su memoria. El elemento 104, anteriormente llamado kurchatovio, recibió en 1997 el nombre de rutherfordio por la IUPÄC.
El billete de la quinta serie de 100 dólares neozelandeses lanzada en 1992, lleva la imagen de Rutherford, y está vigente aún en 2022. En su natal Brighwater, tiene un memorial en la Lord Rutherford Road, donde puede verse una estatua que lo representa de niño.

Estatua de Ernest Rutherford en su memorial en Brightwater, Nueva Zelanda
Nunca olvidó a su natal Nueva Zelanda, la que visitó por última vez en 1925, siendo recibido con todos los honores.
A pesar de sus reconocimientos y fama, Rutherford siempre fue reconocido como una persona jovial y generosa, aspectos que lo hicieron tan respetado como por su autoridad intelectual. Consciente del devenir histórico de la Ciencia y de su construcción colectiva, expresó:
“No es natural que un solo hombre pueda hacer un descubrimiento repentino, la ciencia va paso a paso y cada hombre depende de la obra de sus predecesores… Los científicos no dependen de las ideas de un solo hombre, sino de la sabiduría combinada de miles de hombres, todos pensando sobre el mismo problema y cada uno de ellos haciendo su pequeña aportación a añadir a la gran estructura de conocimiento que se va construyendo poco a poco.” (Heywood, R. (1947) The works of the mind, The scientist).
Por lo mismo que era un ferviente devoto de los hechos y de los futuros descubrimientos de la Física que develarían la naturaleza del mundo físico, no dejó de recocer sus limitaciones para uno de los más grandes misterios del Universo:
“Cuando hayamos descubierto cómo se construye el núcleo de los átomos, habremos encontrado el mayor secreto de todos, excepto la vida. Habremos encontrado la base de todo: de la Tierra que pisamos, del aire que respiramos, de la luz del Sol, de nuestro propio cuerpo físico, de todo lo que hay en el mundo, por grande o por pequeño que sea, excepto la vida.” (Pepper, F. (1987) The Wit and Wisdom of the 20th Century: A Dictionary of Quotations).
La vida de Rutherford resulta significativa del logro que puede llegar a tener una persona por sus propios méritos. Nacido en una familia numerosa y de escasos recursos, en un pequeño pueblo de una isla en el otro extremo del mundo, llegó a ser reconocido gracias a su dedicación y constancia, como el padre de la física nuclear, alcanzando títulos nobiliarios y ganándose el honor de ser sepultado en un lugar emblemático del Reino Unido junto a otros grandes hombres.
REFERENCIAS
Anirudh (2016) Ernest Rutherford | 10 Facts About The Famous Scientist. En Learnodo Newtonic. Disponible: https://learnodo-newtonic.com/ernest-rutherford-facts [Consulta: 2022, mayo 22].
Energía Nuclear (s/f) Modelo atómico de Ernest Rutheford, el modelo planetario. Disponible: https://energia-nuclear.net/que-es-la-energia-nuclear/atomo/modelos-atomicos/modelo-atomico-de-rutherford [Consulta: 2022, mayo 22].
Fernández, Tomás y Tamaro, Elena. «Biografia de Ernest Rutherford». En Biografías y Vidas. La enciclopedia biográfica en línea [Internet]. Barcelona, España, 2004. Disponible en https://www.biografiasyvidas.com/biografia/r/rutherford.htm [Consulta: 2022, mayo 22].
Física Cuántica en la Red. (s/f) Los modelos atómicos primitivos. Disponible: http://www.fisicacuantica.es/los-modelos-atomicos-primitivos/ [Consulta: 2022, agosto 18].
Frases de Famosos (s/f) Frases de Ernest Ruherford. Disponible: https://citas.in/autores/ernest-rutherford/ [Consulta: 2022, agosto 120].
Limmer, M. (2020) Ernest Rutherford's early life en The Prow.org.nz Disponible: https://www-theprow-org-nz.translate.goog/yourstory/ernest-rutherford-early-life/?_x_tr_sch=http&_x_tr_sl=en&_x_tr_tl=es&_x_tr_hl=es&_x_tr_pto=sc [Consulta: 2022, mayo 22].
Geo Enciclopedia (s/f) Modelo atómico de Rutherford. Disponible: https://www.geoenciclopedia.com/modelo-atomico-de-rutherford/ [Consulta: 2022, agosto 01].
Grupo de Física Nuclear (s/f) Radiactividad. Facultad de Física UCM. Disponible: http://nuclear.fis.ucm.es/FERIA/FERIA2.html [Consulta: 2022, agosto 01].
Stephens, J. (2020) Rutherford and Pickering at Havelock School en The Prow.org.nz https://www-theprow-org-nz.translate.goog/people/rutherford-and-pickering-at-havelock-school/?_x_tr_sl=en&_x_tr_tl=es&_x_tr_hl=es&_x_tr_pto=sc&_x_tr_sch=http [Consulta: 2022, junio 20].
Wikipedia (s/f). Ernest Rutherford. [Enciclopedia en línea]. Disponible: https://es.wikipedia.org/wiki/Ernest_Rutherfordhttps://es.wikipedia.org/wiki/Ernest_Rutherford [Consulta: 2022, mayo 22].
CRÉDITOS DE IMÁGENES
Ernest Rutherford. [Herbert photograph studios], Alexander Turnbull Library, 1/2-050243-F http://mp.natlib.govt.nz/ detail/?id=7208 Descargada: 22-05-22.
Experimento de la lámina de oro, resultados esperado y obtenido. https://www.geoenciclopedia.com/modelo-atomico-de-rutherford/ Descargada: 01-08-22.
Modelo atómico de Rutherford. https://energia-nuclear.net/que-es-la-energia-nuclear/atomo/modelos-atomicos/modelo-atomico-de-rutherford Descargada: 22-05
Primera Conferencia Solvay. https://es.wikipedia.org/wiki/Ernest_Rutherford#/media/Archivo:1911_Solvay_conference.jpg Descargada: 17-07-22.
Estatua de Ernest Rutherford en su memorial en Brightwater. https://es.wikipedia.org/wiki/Brightwater#/media/Archivo:Statue_of_Ernest_Rutherford.JPG Descargada: 22-05-.22